Eine exzellente Darmreinigung sollte bei der Darmvorbereitung Priorität haben, denn sie hat eine entscheidende Bedeutung bei der Darmkrebsprävention.1
Adenomdetektionsrate (ADR) bei exzellenter Reinigung vs. adäquater Reinigung
Kombinierte Post-hoc-Analyse von 3 randomisierten Studien in Europa und den USA unter Berücksichtigung aller
7 Therapiearme der DAYB-, MORA- und NOCT-Studie1
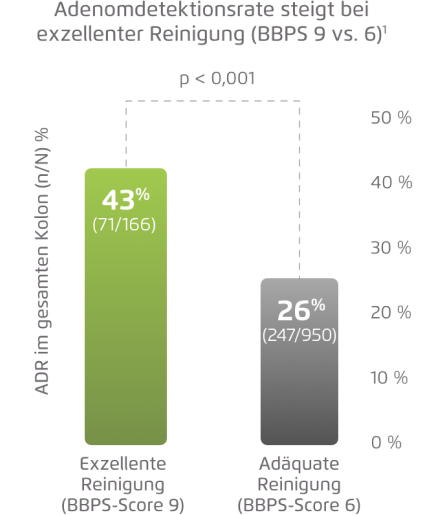
Abbildung modifiziert nach Hassan, et al, 2020.1
- Eine exzellente Darmreinigung verbessert die ADR.1
- Patienten mit einer exzellenten Darmreinigung erhalten eine bessere Darmkrebsprävention.1
Bestimmung des Anteils der Patienten mit entdeckten SSPs in unterschiedlichen Qualitätsstufen der Darmvorbereitung
Prospektive, monozentrische US-Studie; n = 749.2
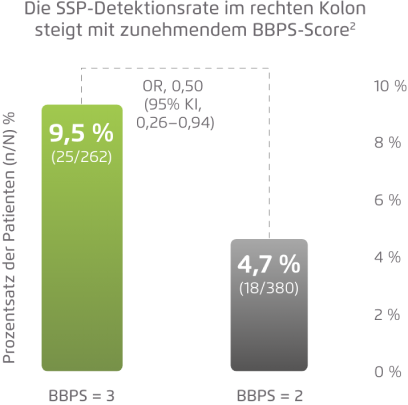
Abbildung modifiziert nach Clark & Laine 2016.2
- Eine exzellente Darmreinigung verbessert die Detektion von sessil serratierten Polypen (SSP).2
- Bei subtilen, flachen Läsionen, wie z. B. SSP, werden die Detektionsraten selbst durch eine leichte Verringerung der Reinigungsqualität unter den exzellenten Bereich negativ beeinflusst.1
... und eine suboptimale Darmvorbereitung kann Folgen haben3–5

Übersehenes
Adenom3

Erhöhte Schwierigkeit/Dauer der Koloskopie4

Erhöhtes Risiko von unerwünschten Ereignissen3

Höhere
Kosten3-4

Unnötige Wiederholungsuntersuchungen/Missachtung der Empfehlungen zur Darmkrebsvorsorge3,5

Verschwendung von Zeit und Geld. Neuer Termin nötig.
Referenzen:
- Hassan C, et al. Endosc Int Open 2020; 08: E928–E937.
- Clark BT & Laine L. Clin Gastroenterol Hepatol 2016; 14: 1155–1162.
- ASGE-Ausschuss für Praxisstandards. Gastrointest Endosc. 2015; 81(4): 781–794.
- Burke CA, et al. Gastrointest Endosc 2007; 66(3): 565–573.
- Singhal S, et al. Stand J Gastroenterologie. 2014; 49(7): 885–890.
BBPS = Boston Bowel Preparation Scale
KI = Konfidenzintervall
OR = Odds Ratio
SSP = sessile serratierte Polypen



